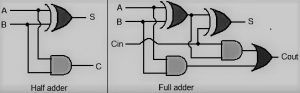
Suchý článek je nejjednodušší formou zdroje vyrábějícího elektřinu. Řada článků dohromady tvoří baterii. The kyselina olovnatá nebo nikl-kadmium baterie je pokročilá verze suché buňky. Tato buňka byla poprvé vynalezena francouzským inženýrem Georgesem Leclanche v roce 1866. Jeho vynález byl pojmenován podle jeho jména jako Leclanche baterie. Ale v té době to bylo velmi těžké a dalo se to snadno rozbít. Suchý článek má stejný princip a jedná se o pokročilou verzi baterie Leclanche a dodává se v různých napětích a velikostech. Komerční forma článku zinek-uhlík, což je upravená forma baterie Leclanche, vynalezl v roce 1881 Carl Gassner z Mainzu. Vyrábí se ve velkém množství a používá se v mnoha aplikacích, jako jsou hračky, rádia, kalkulačky atd.
Co je to suchá buňka?
Suchý článek je zařízení, které vyrábí elektřinu na základě chemických reakcí. Když jsou dvě elektrody článku spojeny uzavřenou cestou, pak buňka nutí elektrony proudit z jednoho konce na druhý. Tok elektronů způsobuje tok proudu v uzavřeném okruhu.

Suché vrstvy buněk
Pomocí chemických reakcí proudí elektrony z jednoho konce na druhý. Když jsou dva nebo více článků propojených se správnou polaritou, protéká více elektronů kvůli vysokému potenciálu. Tato kombinace se nazývá baterie. Od minimálního napětí 1,5 V do 100 V lze použít baterii k získání rozsahu napětí. Dokonce i výstupní stejnosměrné napětí baterie lze regulovat na různé úrovně pomocí výkonových elektronických převodníků vrtulník obvodů.
Struktura buňky
Struktura suché buňky zinek-uhlík je znázorněna na obrázku. Skládá se z anodové svorky jako zinek nebo obecně z grafitové tyče. Uhlí tvoří katodovou svorku. Lze pozorovat, že ve starších verzích suchých článků byl zinek používán jako katoda a grafit jako anodový terminál. Výběr prvků je zásadně založen na jeho chemické konfiguraci nejvzdálenější oběžné dráhy prvků.

Struktura suché buňky
Pokud má na nejvzdálenější oběžné dráze více číselných elektronů, může působit jako dárce, a tudíž tvoří katodu. Podobně, pokud má nejvzdálenější oběžná dráha méně elektronů, může ji snadno přijmout, a proto tvoří anodu. Mezi nimi umístěný elektrolyt působí jako katalyzátor chemických reakcí. Obecně používáme jako elektrolyt želé chloridu amonného. Na obrázku je použitým elektrolytem směs zinku a chloridu. Chlorid sodný se také používá jako elektrolyt. Kolem anodové tyče je obklopena směs oxidu manganičitého a uhlíku.
Celá konfigurace je umístěna v kovové trubce. Želé je zabráněno vysychání pomocí smoly v horní části buňky. Ve spodní části je umístěna uhlíková podložka. Účelem této podložky je zabránit kontaktu zinkové anodové tyče s nádobou.
Tomu se také říká spacer, jak je znázorněno na obrázku. Zinková plechovka je také pro izolační účely obklopena papírovou izolací. U velkých baterií se také používají jiné izolační materiály, jako je slída atd. Kladný terminál ell je vytvořen nahoře. Záporný terminál buňky je tvořen na základně.
Práce se suchou buňkou
Suchá buňka zásadně pracuje na chemických reakcích. V důsledku reakcí, které probíhají mezi elektrolytem a elektrodami, proudí elektrony z jedné elektrody na druhou. Látky, jako jsou kyseliny, se rozpouštějí ve vodě za vzniku ionizovaných částic. Ionizovaná částice je dvou typů. Kladné ionty se nazývají kationty a záporné ionty se nazývají anionty. Kyseliny, které jsou rozpuštěny ve vodě, se nazývají elektrolyty.
Ve výše uvedeném diagramu se chlorid zinečnatý tvoří jako elektrolyt. Podobně se želé chloridu amonného tvoří také jako elektrolyt. Kovové tyče ponořené do elektrolytů tvoří elektrody. Na základě chemických charakteristik kovových tyčí máme kladnou elektrodu jako anodu a zápornou elektrodu jako katodu.
Elektrody přitahují na svou stranu opačně nabité ionty. Například katoda přitahuje anionty a anoda přitahuje kationty. V tomto procesu elektrony proudí z jednoho směru do druhého, a proto získáváme tok nábojů. Tomu se říká aktuální .
Chemické reakce
Níže jsou uvedeny reakce probíhající v buňce. První je oxidační reakce.

Přitom se zinková katoda oxiduje na kladně nabité ionty zinku za uvolnění dvou iontů. Tyto elektrony jsou sbírány anodou. Poté přichází redukční reakce.

Redukční reakce na anodě je uvedena výše. Tato reakce produkuje elektrický proud. Uvolňuje oxidové ionty s oxidem hořečnatým. Tato reakce se tvoří, když se hořčík kombinuje s elektrolytem.


Další dvě reakce představují acidobazickou reakci a srážecí reakci probíhající v suché buňce. Při acidobazické reakci se NH kombinuje s OH za vzniku NH3 spolu s vodou. Výsledkem je NH3 a vodní báze.
Rozdíl mezi suchou a mokrou buňkou
Hlavní rozdíl mezi suchým článkem a mokrým článkem je forma elektrolytu. Jak již bylo uvedeno výše, v suchém článku je elektrolyt, jako je chlorid amonný, v přírodě suchý. Takové suché články jsou běžnější a používají se v hračkách, rádiích atd. Ale ve vlhkém článku je elektrolyt v kapalném stavu.
Používají se kapalné elektrolyty, jako je kyselina sírová, která je nebezpečnou žíravou kapalinou. Vzhledem k povaze těchto kapalin je vlhký článek výbušnější povahy a je třeba s ním zacházet opatrně. Největší výhodou takových mokrých článků je to, že je lze snadno dobít a použít pro četné aplikace. Takové baterie nacházejí běžné využití v letectví, veřejných službách, skladování energie a věží mobilních telefonů.
Funkce suchých buněk
Funkce suchého článku na základě chemických reakcí mezi elektrodou a elektrolyty. Když jsou elektrody umístěny v elektrolytech, přitahuje to opačně nabité ionty k sobě. To způsobuje tok nábojů, a proto se vytváří proud.
Výhody
The výhody suché buňky zahrnout následující.
- Suchá buňka má řadu výhod, jako je
- Má malou velikost.
- Může mít různé úrovně napětí.
- Je praktický a má mnoho aplikací.
- Je to jediný zdroj stejnosměrného napětí.
- Může být použit spolu s výkonovými elektronickými obvody k regulaci výstupního napětí
- Je dobíjecí.
Nevýhody
The nevýhody suché buňky zahrnout následující.
- Musí se s ním zacházet opatrně
- Je to výbušné
- Baterie s velkým hodnocením jsou velmi těžké
Aplikace
The aplikace suché buňky zahrnout následující.
- Hračky
- Letectví
- Mobily
- Rádio
- Kalkulačka
- Hodinky
- Naslouchátka
Proto jsme viděli fungování, klasifikaci a aplikace suché buňky . Jedním zajímavým bodem, který je třeba poznamenat, je, že baterie funguje pouze tehdy, když jsou elektrody navzájem fyzicky v kontaktu. Mezi oběma elektrodami musí existovat vodivé médium. Otázkou je, zda lze vodu použít jako vodivé médium mezi elektrodami suchého článku? V takovém případě, co se stane, pokud je tato buňka ponořena do vody?